SOAL NO. 1 TENTANG STRUKTUR ATOM
Berikut ini beberapa senyawa kovalen:
Senyawa kovalen yang mengalami penyimpangan kaidah oktet dalam struktur Lewisnya adalah ....
(1) CH4(Nomor atom: C = 6; H = 1; N = 7; P = 15; Cl = 17; dan O = 8)
(2) NH3
(3) PCl5
(4) PCl3
(5) CO2
Senyawa kovalen yang mengalami penyimpangan kaidah oktet dalam struktur Lewisnya adalah ....
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
PEMBAHASAN
Untuk menjawab soal di atas, Anda harus hafal nomor atom unsur-unsur gas mulia berikut ini:2 10 18 36 54 86Caranya, nomor atom unsur-unsur yang diketahui pada soal dikurangi dengan nomor atom unsur gas mulia terdekat. Nomor atom unsur pertama pada senyawa kovalen dikurangi nomor atom gas mulia yang lebih kecil sehingga hasilnya positif. Sedang nomor atom unsur kedua dikurangi nomor atom gas mulia yang lebih besar sehingga hasilnya negatif. Hasil pengurangan yang negatif ini kemudian diberi harga mutlak.
Selanjutnya nilai yang diperoleh dijumlahkan. Jika hasilnya 8 maka senyawa kovalen tersebut memenuhi kaidah oktet. Jika tidak, berarti menyimpang dari kaidah oktet.
C : 6 - 2 = 4
H : 1 - 2 = |-1| = 1
CH4 = 4 + 1 x 4 = 8 (oktet).
N : 7 - 2 = 5
H : 1
NH3 = 5 + 1 x 3 = 8 (oktet).
P : 15 - 10 = 5
Cl : 17 - 18 = |-1| = 1
PCl5 = 5 + 1 x 5 = 10 (bukan oktet).
PCl3 = 5 + 1 x 3 = 8 (oktet).
C = 4
O = 8 - 10 = |-2| = 2
CO2 = 4 + 2 x 2 = 8 (oktet).
Jadi, senyawa kovalen yang mengalami penyimpangan kaidah oktet adalah PCl5 (C).
SOAL NO. 2 TENTANG SISTEM PERIODIK UNSUR
Unsur L dinotasikan sebagai berikut:
Konfigurasi elektron dan letak unsur L pada tabel periodik, sesuai dengan golongan dan periodenya, secara berturut-turut adalah ....
| Konfigurasi Elektron | Golongan | Periode | |
| A B C D E | [Ar] 4s2 3d8 [Ar] 4s2 4p6 3d2 [Ar] 4s2 3d5 4p3 [Xe] 6s2 3f3 [Xe] 6s2 4f3 | VIII B VIII B VB lantanida lantanida | 4 3 4 6 6 |
PEMBAHASAN
Yang perlu diperhatikan hanya nomor atomnya, yaitu 28.28L : 1s2 2s2 2p6 3s2 3p6 4s2 3d8Golongan ditentukan berdasarkan jumlah elektron valensi.
28L : [Ar] 4s2 3d8
- Valensi golongan A adalah ns dan ns np.
- Valensi golongan B adalah ns (n-1)d.
- Valensi golongan lantanida 6s 4f.
- Valensi golongan aktinida 7s 5f.
Golongan = 2 + 8 = 10 (jumlah 8, 9, dan 10 masuk golongan VIII), karena bervalensi ns (n-1)d maka termasuk golongan VIII B.
Periode = 4.
Jadi, unsur L mempunyai konfigurasi elektron [Ar] 4s2 3d8 dan terletak pada golongan VIII B periode 4 (A).
SOAL NO. 3 TENTANG IKATAN KIMIA
Jika atom 4X dan 17Y berikatan, bentuk molekul dan sifat kepolaran yang terbentuk adalah ....
A. segi empat planar dan polar
B. linear dan polar
C. tetrahedral dan nonpolar
D. oktahedral dan nonpolar
E. linear dan nonpolar
PEMBAHASAN
Langkah pertama untuk menentukan bentuk molekul dan sifat kepolaran adalah menentukan elektron valensi (elektron terluar) masing-masing unsur.X : 2, 2 (mempunyai 2 elektron terluar)
Y : 2, 8, 7 (mempunyai 7 elektron terluar)
Ikatan yang terbentuk adalah XY2. Artinya, kedua elektron terluar unsur X masing-masing berikatan dengan satu elektron dari dua unsur Y sehingga tidak terdapat elektron bebas.
Atom X sebagai atom pusat mempunyai 2 PEI (pasangan elektron ikatan) dan tidak mempunyai PEB (pasangan elektron bebas). Dengan demikian senyawa yang terbentuk mempunyai tipe AX2 dengan bentuk molekul linear.
Karena tidak mempunyai pasangan elektron bebas, bentuk molekulnya simetris. Bentuk molekul yang simetris ini adalah salah satu ciri senyawa nonpolar.
Jadi, senyawa yang terbentuk mempunyai bentuk molekul linear dan bersifat nonpolar (E).
SOAL NO. 4 TENTANG IKATAN MOLEKUL
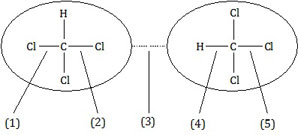
Perhatikan ilustrasi dari triklorometana, CHCl3, berikut!
Gaya dipol sesaat ditunjukkan oleh nomor ....
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
PEMBAHASAN
Dipol sesaat terjadi pada molekul nonpolar. Jika pada molekul nonpolar, misal CHCl3, terjadi dipol sesaat maka antarmolekul tersebut terjadi gaya yang dikenal dengan gaya London.Kata kunci pengertian di atas adalah molekul nonpolar dan antarmolekul. Dengan kata kunci antarmolekul, soal di atas langsung bisa dijawab hanya dengan melihat gambar. Ini adalah soal pandangan mata. Coba perhatikan gambar pada soal, hanya opsi (3) yang menunjukkan gaya antarmolekul, sedangkan opsi yang lain menunjukkan gaya antaratom.
Jadi, gaya dipol sesaat ditunjukkan oleh nomor 3 (C).
SOAL NO. 5 TENTANG HUKUM DASAR KIMIA
Perhatikan tabel percobaan reaksi pembentukan gas CO2 dari karbon dan oksigen berikut ini!
Berdasarkan tabel, perbandingan massa C dan O dan senyawa CO2 adalah ....
| Massa C (gram) | Massa O (gram) | Massa CO2 (gram) |
| 1,5 3,0 4,0 5,0 | 4 8 8 12 | 5,5 11,0 11,0 16,5 |
Berdasarkan tabel, perbandingan massa C dan O dan senyawa CO2 adalah ....
A. 1 : 3
B. 1 : 4
C. 3 : 1
D. 3 : 8
E. 4 : 1
PEMBAHASAN
Hukum kekekalan massa (hukum Lavoisier) menyatakan:Dalam reaksi kimia, massa zat-zat sebelum dan sesudah reaksi adalah sama.
Isi tabel yang sesuai dengan hukum Lavoisier adalah baris 1 dan baris 2.
Baris 1: 1,5 + 4 = 5,5
Baris 2: 3,0 + 8 = 11,0
Sedangkan baris 3 dan 4 adalah reaksi berlebih. Artinya, pada akhir reaksi masih terdapat sisa zat yang tidak bereaksi. Contoh baris 3, massa C yang tersedia 4 gram dan yang bereaksi 3 gram sehingga tersisa 1 gram. Hal ini sesuai dengan Hukum Perbandingan Tetap yang dikemukakan oleh Joseph Proust.
Jadi, perbandingan massa C dan massa O adalah 1,5 : 4 atau 3 : 8 (D)
SOAL NO. 6 TENTANG STOIKIOMETRI
Pada pembuatan gas amonia (NH3) menurut proses Haber Bosch, dilakukan dengan cara mereaksikan gas nitrogen dan gas hidrogen sesuai persamaan reaksi:
N2(g) + H2(g) → NH3(g) (belum setara)Gas nitrogen (Ar N = 14) yang direaksikan sebanyak 14 gram. Volume gas amonia (NH3) yang dihasilkan pada keadaan 0 °C, 1 atm adalah ....
A. 1,12 liter
B. 2,24 liter
C. 11,2 liter
D. 22,4 liter
E. 33,6 liter
PEMBAHASAN
Langkah pertama adalah menyetarakan reaksi terlebih dahulu.N2(g) + 3H2(g) → 2NH3(g)Langkah berikutnya adalah menentukan nilai mol dari gas nitrogen. Hal ini karena hanya nilai besaran nitrogen yang diketahui, yaitu massa 14 gram dan Mr = 2 × 14 = 28.
Nilai mol N2 ini digunakan untuk menentukan nilai mol NH3 dengan memanfaatkan hukum kesetaraan antara mol dan koefisien.
Selanjutnya nilai mol NH3 ini digunakan untuk menentukan volume gas NH3. Volume pada keadaan 0 oC, 1 atm (STP) adalah 22,4 liter. Diperoleh:
volume NH3 = 1 × 22,4 = 22,4Jadi, Volume gas amonia (NH3) yang dihasilkan pada keadaan 0 oC, 1 atm adalah 22,4 liter (D).
SOAL NO. 7 TENTANG TATA NAMA DAN PERSAMAAN REAKSI
Serbuk tembaga (II) oksida larut dalam asam klorida membentuk tembaga (II) klorida dan air. Persamaan reaksi setara dan lengkap dari reaksi tersebut adalah ....
A. Cu2O (s) + HCl (aq) → Cu2Cl (aq) + H2O (l)
B. Cu2O (s) + 2HCl (aq) → 2 CuCl (aq) + H2O (l)
C. CuO (s) + HCl (aq) → CuCl (aq) + H2O (l)
D. CuO (s) + 2 HCl (aq) → CuCl2 (aq) + H2O (l)
E. Cu2O (s) + 4 HCl (aq) → 2 CuCl2 (aq) + 4 H2O (l)
PEMBAHASAN
Senyawa logam yang mempunyai atom logam dengan bilangan oksidasi lebih dari satu, penamaannya adalah:
nama logam + (huruf romawi biloks logam) + nama nonlogam + ida
- CuO : tembaga (II) oksida (biloks O = -2 sehingga biloks Cu = +2).
- Cu2O : tembaga (I) oksida (biloks O = -2 sehingga biloks 2 Cu = +2, biloks Cu = +1).
- CuCl : tembaga (I) klorida (biloks Cl = -1 sehingga biloks Cu = +1).
- CuCl2 : tembaga (II) klorida (biloks 2 Cl = -2 sehingga biloks Cu = +2).
- Cu2Cl : tidak ada senyawa Cu2Cl (lucu kan, kalau biloks Cu = ½).
SOAL NO. 8 TENTANG LARUTAN ELEKTROLIT DAN NONELEKTROLIT.
Berikut data hasil pengujian terhadap beberapa air limbah beserta nilai derajat ionisasinya (α).
Pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah ....
| Air Limbah | Nyala Lampu | Gelembung Gas | α |
| K L M N O | terang tidak tidak tidak redup | ada ada tidak ada tidak ada ada | 1 0,001 0 0 1 |
Pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah ....
A. K dan L
B. K dan M
C. L dan M
D. L dan N
E. L dan O
PEMBAHASAN
Untuk menjawab soal di atas, perhatikan tabel berikut!| Larutan | Nyala Lampu | Gelembung Gas | α |
| Elektrolit kuat Elektrolit lemah Nonelektrolit | terang redup mati | banyak sedikit tidak ada | 1 0 < α < 1 0 |
Berdasarkan tabel di atas, pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah K dan M atau K dan N. Opsi jawaban yang ada adalah K dan M (B).
SOAL NO. 9 TENTANG PH ASAM DAN BASA
Gas HCl murni 24 ml ditiupkan ke dalam 250 ml air sehingga tidak merubah volume air. Tekanan gas semula 76 cmHg dan temperaturnya 27 °C. Kalau tetapan gas ideal adalah R = 0,08 L.atm/mol.K dan log 4 = 0,6 maka pH larutan HCl adalah ....
A. 1,70
B. 2,40
C. 2,47
D. 3,20
E. 3,40
PEMBAHASAN
Kita tentukan dulu nilai mol dari gas HCl. Namun sebelumnya kita mengonversi beberapa satuan sebagai berikut:V = 24 ml = 24 × 10-3 liter.Mengonversi satuan tersebut karena pada tetapan R terkandung satuan liter, atm, dan K.
p = 76 cmHg = 1 atm.
T = 27 °C = 300 K
Selanjutnya, mari kita tentukan nilai mol gas HCl dengan menggunakan persamaan gas umum pV = nRT.
Gas HCl 10-3 mol tersebut ditiupkan ke dalam 250 ml air sehingga konsentrasi molarnya adalah:
Dengan konsentrasi molar tersebut, gas HCl yang terlarut dalam air mempunyai pH:
[H+] = a × M = 1 × 4 ⋅ 10-3 = 4 ⋅ 10-3Jadi, pH larutan gas HCl adalah 2,40 (B).
pH = 3 - log 4 = 3 - 0,6 = 2,4
SOAL NO. 10 TENTANG LARUTAN PENYANGGA
Perhatikan kurva perubahan harga pH pada titrasi CH3COOH dengan NaOH berikut!
Daerah kurva yang merupakan larutan penyangga adalah ....
A. R
B. T
C. Z
D. Y
E. Q
PEMBAHASAN
Larutan penyangga adalah larutan yang berfungsi untuk mempertahan pH dari penambahan sedikit asam, sedikit basa, atau pengenceran. Pada soal di atas, asam asetat atau CH3COOH yang bersifat asam lemah dititrasi oleh NaOH yang bersifat basa kuat. Pada awal titrasi, asam asetat cenderung mempertahankan pH-nya. Tetapi jika titrasi dilanjutkan maka asam asetat sudah tidak dapat lagi mempertahankan pH-nya. pH-nya akan semakin naik sampai menjadi basa.Jadi, kurva yang merupakan larutan penyangga adalah kurva awal titrasi yang cenderung mendatar, yaitu Q (E).
SOAL NO. 11 TENTANG LARUTAN PENYANGGA
Berikut ini merupakan senyawa/ion yang dapat bersifat larutan penyangga.
(1) CH3COOH dan CH3COO−Larutan penyangga yang terdapat dalam cairan ekstrasel makhluk hidup adalah nomor ....
(2) NH3 dan NH4+
(3) HCOOH dan HCOO−
(4) H2CO3 dan HCO3−
(5) C5H7O4CO2H dan C5H7O4CO2−
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
PEMBAHASAN
Larutan penyangga alami yang terdapat dalam cairan ekstrasel makhluk hidup adalah H2CO3 dan HCO3-. Larutan penyangga ini berfungsi untuk mempertahankan pH darah sekitar 7,4. pH darah tidak boleh turun di bawah 7,0 atau naik di atas 7,8. Jadi opsi jawaban yang benar adalah (D).SOAL NO. 12 TENTANG HIDROLISIS
Larutan 25 ml CH3COOH 0,2 M direaksikan dengan 25 ml NaOH 0,2 M sesuai reaksi:
CH3COOH (aq) + NaOH (aq) → CH3CONa (aq) + H2O (l)Jika Ka CH3COOH = 10−5 maka pH larutan yang terbentuk adalah ....
A. 5 − log 2
B. 7 + log 1
C. 9 + log 1
D. 13 − log 2
E. 13 + log 2
PEMBAHASAN
Kita periksa dulu jumlah mol asam dan basanya.mol CH3COOH = 25 ml × 0,2 M = 5 mmolKarena mol CH3COOH sama dengan mol NaOH maka pada reaksi tersebut terjadi hidrolisis garam. Mol garam juga sama dengan 5 mmol karena perbandingan koefisiennya sama. Sedangkan volumenya merupakan volume campuran (25 ml + 25 ml = 50 ml) karena garam tersebut terhidrolisis dalam air. Sehingga konsentrasi molar garam tersebut adalah:
mol NaOH = 25 ml × 0,2 M = 5 mmol
Hidrolisis garam tersebut berasal dari asam lemah dan basa kuat sehingga garamnya bersifat basa. Dengan demikian rumus hidrolisisnya adalah:
Jadi, pH larutan yang terbentuk adalah 9 + log 1 (C).
pOH = 5 − log 1
pH = 14 − (5 − log 1) = 9 + log 1
SOAL NO. 13 TENTANG KELARUTAN DAN HASIL KALI KELARUTAN
100 ml NaOH 0,008 M direaksikan dengan 100 ml CH3COOH 0,008 M. Ke dalam larutan reaksi ditetesi larutan encer CaCl2 dan penetesan diakhiri ketika di larutan tepat jenuh atau tepat Ca(OH)2 akan mengendap. Kalau Kw = 10−14, KspCa(OH)2 = 4 × 10−16, dan Ka = 10−5 maka [Ca2+] pada saat tepat jenuh adalah ....
A. 10−1 M
B. 10−2 M
C. 10−3 M
D. 10−4 M
E. 10−5 M
PEMBAHASAN
Mula-mula akan terjadi hidrolisis garam dengan konsentrasi garam = 0,8 mmol : 200 ml = 4 × 10−3. Hidrolisis garam tersebut bersifat basa sehingga dapat diperoleh:Tepat saat Ca(OH)2 akan mengendap, berlaku:
Ca(OH)2 → Ca2+ + 2 OH−Jadi, konsentrasi Ca2+ pada saat tepat jenuh adalah 10−4 M (D).
Ksp Ca(OH)2 = [Ca2+] . [OH−]2
4 × 10-16 = [Ca2+] . (2 × 10−6)2
[Ca2+] = 10−4
SOAL NO. 14 TENTANG SIFAT KOLIGATIF LARUTAN
Berikut ini peristiwa kimia dalam kehidupan sehari-hari:
(1) etilen glikol dapat ditambahkan ke dalam radiator mobil, danKedua contoh di atas berhubungan dengan sifat koligatif larutan secara berturut-turut ....
(2) desalinasi air laut.
A. penurunan tekanan uap dan tekanan osmotik
B. tekanan osmotik dan kenaikan titik didih
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan osmosis balik
E. penurunan titik beku dan kenaikan titik didih
PEMBAHASAN
Di daerah yang beriklim dingin, air radiator mudah membeku. Untuk mengatasinya, ke dalam air radiator biasanya ditambahkan etilen glikol. Etilen glikol ini berfungsi untuk menurunkan titik beku. Sehingga pada suhu yang dingin, air radiator campuran ini belum membeku karena titik bekunya sudah turun.Desalinisasi air laut adalah proses pembuatan air murni dari air laut. Mula-mula air laut dipisahkan dengan membran semipermeabel. Dengan memberi tekanan yang cukup, partikel air pada air laut akan mampu menembus membran. Sementara itu, partikel-partikel lain yang terkandung dalam air laut akan tertahan. Proses ini disebut osmosis balik.
Jadi, penambahan etilen glikol dan desalinisasi air laut berhubungan dengan penurunan titik beku dan osmosis balik (D).
SOAL NO. 15 TENTANG SISTEM KOLOID
Beberapa contoh penerapan sifat koloid dalam kehidupan sehari-hari.
(1) Terjadinya delta di muara sungai.Contoh penerapan sifat koloid dari koagulasi dan dialisis berturut-turut adalah ....
(2) Penggunaan obat norit pada diare.
(3) Peristiwa cuci darah.
(4) Penjernihan air.
(5) Sorot lampu di malam hari.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
PEMBAHASAN
Penerapan sifat koloid dalam kehidupan sehari-hari antara lain:Efek Tyndall
Efek Tyndall adalah peristiwa penghamburan cahaya oleh partikel-partikel koloid. Contoh dalam kehidupan sehari-hari adalah:- langit berwarna biru pada siang hari dan berwarna jingga pada sore hari,
- sorot lampu pada udara yang berkabut, dan
- sinar matahari melalui celah-celah daun pada pagi yang berkabut.
Elektroforesis
Elektroforesis adalah pergerakan partikel koloid yang bermuatan karena pengaruh medan listrik. Dalam kehidupan sehari-hari, elektroforesis diterapkan untuk:- identifikasi DNA,
- mendeteksi kelainan genetik, dan
- penyaringan debu pabrik (Cottrell).
Adsorpsi
Adsorpsi adalah penyerapan partikel bermuatan oleh permukaan-permukaan koloid. Sifat adsorpsi ini biasanya diterapkan untuk:- pemutihan gula pasir,
- penyembuhan diare dengan norit,
- penjernihan air dengan tawas,
- pewarnaan serat wol, dan
- bahan aktif deodorant.
Koagulasi
Koagulasi adalah proses penggumpalan atau pengendapan partikel-partikel koloid. Penerapan koagulasi dalam kehidupan sehari-hari antara lain:- penjernihan air,
- pengolahan karet dari lateks,
- pembuatan tahu,
- penggumpalan debu atau asap pabrik, dan
- pembentukan delta di muara sungai.
Koloid Pelindung
Koloid pelindung adalah koloid yang dapat melindungi koloid lain agar stabil, misal tidak mengalami koagulasi. Contoh penerapannya adalah:- penambahan kasein pada susu,
- penambahan lisitin pada margarin,
- penambahan gelatin pada es krim, dan
- penambahan minyak silikon pada cat.
Dialisis
Dialisis adalah proses pemisahan koloid dengan larutan sejati melalui membran semipermeabel. Penerapan sifat koloid ini dalam kehidupan sehari-hari adalah:- proses cuci darah pada pasien gagal ginjal dan
- pemisahan ion sianida dari tepung tapioka.
SOAL NO. 16 TENTANG BENZENA DAN TURUNANNYA
Berikut ini beberapa kegunaan senyawa benzena:
(1) bahan pembuat anilina,Kegunaan dari nitrobenzena adalah ....
(2) pengawet kayu,
(3) bahan pembuat semir sepatu,
(4) pengawet makanan, dan
(5) bahan baku pembuatan peledak.
A. (1) dan (2)
B. (1) dan (3)
C. (3) dan (4)
D. (3) dan (5)
E. (4) dan (5)
PEMBAHASAN
Kegunaan nitrobenzena antara lain:- pewangi sabun,
- bahan dasar anilina,
- pengkilap lantai,
- pelarut cat,
- bahan pembuatan semir, dan
- zat aditif pada karet.
- penyebab kanker darah putih (leukemia),
- penyebab kematian (jika menghirup dalam kadar yang tinggi).
SOAL NO. 17 TENTANG SENYAWA ORGANIK DAN ANORGANIK
Perhatikan beberapa karakteristik senyawa organik dan anorganik berikut!
(1) Titik leleh dan titik didih tinggi.Senyawa organik ditunjukkan oleh nomor ....
(2) Ikatannya bersifat kovalen.
(3) Di alam ditemukan sebagai garam mineral.
(4) Hasil pembakarannya menghasilkan air dan karbondioksida.
(5) Ikatannya bersifat ionik.
A. (1) dan (2)
B. (1) dam (3)
C. (2) dan (3)
D. (2) dan (4)
E. (2) dan (5)
PEMBAHASAN
Model soal seperti ini butuh hafalan, pemahaman, dan referensi yang cukup. Baiklah, agar adik-adik tidak disibukkan buka-buka buku, akan Kak Ajaz sampaikan beberapa perbedaan karakteristik antara senyawa organik dan anorganik.Senyawa Organik
Senyawa organik pada mulanya diartikan sebagai senyawa yang berasal dari makhluk hidup. Belakangan, senyawa organik juga bisa disintesis di laboratorium. Definisi pun berubah. Senyawa organik kemudian diartikan sebagai senyawa yang mengandung unsur karbon. Lebih tepatnya disebut senyawa karbon. Contoh senyawa organik adalah golongan alkohol, asam karboksilat, benzena, karbohidrat, protein, dan lain sebagainya. Adapun ciri-cirinya antara lain:- titik didih dan titik leleh rendah,
- tidak tahan terhadap pemanasan,
- berikatan kovalen,
- larut dalam pelarut organik (nonpolar),
- mudah terbakar dan menghasilkan air dan karbondioksida (mengeruhkan air), dan
- struktur molekulnya lebih kompleks.
Senyawa Anorganik
Semua senyawa anorganik berasal dari garam mineral atau bukan berasal dari makhluk hidup. Ciri-ciri senyawa anorganik antara lain:- titik didih dan titik leleh tinggi,
- tahan terhadap pemanasan,
- berikatan ion maupun kovalen,
- larut dalam air (pelarut polar),
- tidak mudah terbakar, dan
- struktur molekulnya sederhana.
Berdasarkan keterangan di atas, yang merupakan karakteristik senyawa organik adalah nomor 2 dan 4 (D).
SOAL NO. 18 TENTANG KARBOHIDRAT
Data yang berhubungan dengan tepat adalah ....
| Jenis Karbohidrat | Hasil Identifikasi | |
| A | Galaktosa | Tidak terbentuk warna merah ungu saat uji Molisch |
| B | Laktosa | Diperoleh dari hidrolisis amilum dengan bantuan enzim |
| C | Glukosa | Hasil tes Fehling menghasilkan warna ungu |
| D | Sukrosa | Tidak menghasilkan Cu2O dengan pereaksi Fehling |
| E | Amilum | Tidak terjadi perubahan warna saat bereaksi dengan iodin |
PEMBAHASAN
Berikut ini beberapa identifikasi atau uji pengenalan karbohidrat yang perlu adik-adik ketahui.Uji Molisch
Uji Molisch sangat efektif untuk membedakan senyawa karbohidrat atau bukan karbohidrat. Uji Molisch dilakukan dengan meneteskan larutan alfanaftol dan asam sulfat pekat pada larutan yang akan diuji. Jika suatu senyawa adalah karbohidrat maka hasil uji menunjukkan adanya cincin atau lapisan warna merah ungu.Uji Benedict dan Fehling
Uji Benedict dan Fehling digunakan untuk menunjukkan adanya gula pereduksi. Berikut ini hasil dari uji Benedict dan Fehling.- fruktosa, glukosa, maltosa, dan laktosa menunjukkan hasil positif,
- sukrosa dan amilum menunjukkan hasil negatif.
Uji Iodin
Uji iodin digunakan untuk membuktikan adanya polisakarida.- amilum menghasilkan warna biru ungu,
- dekstrin menghasilkan warna merah anggur,
- glikogen menghasilkan warna merah coklat, dan
- selulosa menghasilkan warna coklat.
Berdasarkan keterangan di atas, data yang berhubungan dengan tepat adalah opsi (D).
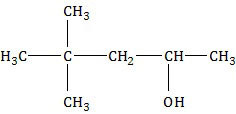
SOAL NO. 19 TENTANG HIDROKARBON
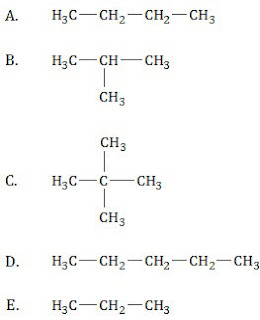
Di antara rumus struktur berikut yang mempunyai titik didih tertinggi adalah ....
PEMBAHASAN
Sifat alkana yang berkenaan dengan titik didih dan titik leleh.- Semakin bertambah jumlah atom C, titik didih dan titik leleh semakin tinggi.
- Alkana rantai lurus mempunyai titik didih dan titik leleh lebih tinggi dibandingkan dengan alkana rantai bercabang.
- Semakin banyak cabang, titik didih dan titik leleh semakin tinggi.
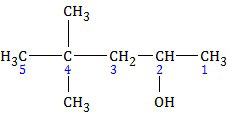
SOAL NO. 20 TENTANG TATA NAMA SENYAWA KARBON
Perhatikan rumus struktur karbon berikut!
A. 4,4-dimetil-2-pentanol
B. 3,3-dimetil-1-pentanol
C. 2,3,4-trimetil-1-pentanol
D. 4,4-dimetil pentanal
E. 3,3-dimetil-2-pentanon
Nama IUPAC salah satu isomer senyawa tersebut adalah ....
A. 4,4-dimetil-2-pentanol
B. 3,3-dimetil-1-pentanol
C. 2,3,4-trimetil-1-pentanol
D. 4,4-dimetil pentanal
E. 3,3-dimetil-2-pentanon
PEMBAHASAN
Penomoran atom C dimulai dari ujung yang paling dekat dengan gugus -OH, yaitu ujung kanan.Nama senyawa alkohol di atas adalah 4,4-dimetil-2-pentanol, opsi (A). Tapi sayang sekali pertanyaan bukan nama senyawa tersebut, melainkan nama salah satu isomer dari senyawa tersebut.
Isomer gugus fungsi dari senyawa alkohol adalah eter atau alkoksi alkana. Opsi (D) adalah alkanal atau aldehid sedangkan opsi (E) adalah alkanon atau keton. Sementara itu, eter tidak ada dalam opsi jawaban. Berarti yang dimaksud adalah isomer rangka. Mari kita bandingkan dua opsi yang tersisa, kita hitung jumlah atom C-nya.
(B) 3,3-dimetil-1-pentanol (dimetil = 2C, pentanol = 5C, total = 7C)Jadi, nama IUPAC salah satu isomer senyawa alkohol tersebut adalah 3,3-dimetil-1-pentanol (B).
(C) 2,3,4-trimetil-1-pentanol (trimetil = 3C, pentanol = 5C, total = 8C)
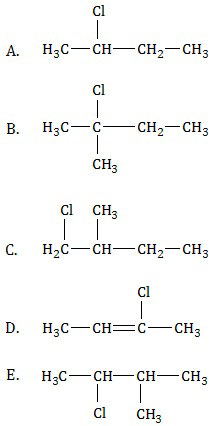
SOAL NO. 21 TENTANG REAKSI SENYAWA KARBON
Apabila 2-metil-1-butena direaksikan dengan asam klorida menurut reaksi:
Produk utama dari reaksi tersebut adalah ....
PEMBAHASAN
Reaksi tersebut adalah reaksi adisi alkena atau reaksi pemutusan ikatan rangkap alkena menjadi alkana, tepatnya menjadi haloalkana karena direaksikan dengan senyawa asam halida. Untuk menyelesaikan reaksi ini harus menggunakan hukum Markovnikov.
Atom H terikat pada atom C rangkap yang mengikat gugus dengan Mr lebih kecil.
Dari hukum Markovnikov tersebut, atom H dari HCl akan terikat pada C1 dan Cl terikat pada C2.
Jadi, produk utama dari reaksi tersebut adalah opsi (B).
SOAL NO. 22 TENTANG POLIMER
Rumus struktur suatu polimer sebagai berikut.
Nama polimer dan kegunaannya adalah ....
A. dakron, serat sintetis
B. protein, pembentuk jaringan tubuh
C. nilon 66, karpet
D. bakelit, alat-alat listrik
E. orlon, kaos kaki
PEMBAHASAN
Rumus struktur polimer di atas mengandung gugus ester (-COO-) sehingga dapat dipastikan polimer tersebut adalah poliester. Poliester tersusun dari dua monomer, yaitu asam tereftalat dan etanadiol. Perhatian reaksi polimerisasinya berikut ini.Gugus -OH pada kedua ujung rantai asam tereftalat lepas. Sedangkan pada etanadiol, yang lepas adalah atom H yang terikat pada O. Induk asam tereftalat akan bergabung dengan induk etanadiol membentuk poliester. Sedangkan gugus -OH akan bergabung dengan atom H membentuk air.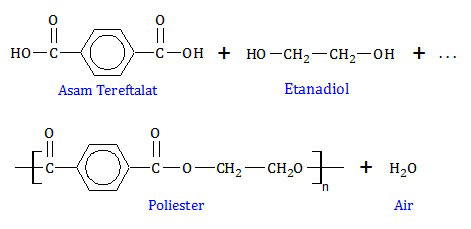
Poliester terdiri dari banyak jenis dan kegunaannya. Jenis poliester yang paling dikenal adalah dakron dan tetoron. Poliester jenis ini digunakan sebagai serat sintetis (A).
SOAL NO. 23 TENTANG KEGUNAAN SENYAWA KARBON
Perhatikan tabel senyawa karbon dan kegunaannya.
Pasangan yang tepat antara senyawa dan kegunaannya adalah ....
| No. | Senyawa | Kegunaan |
| 1 2 3 4 5 | Asam asetat Formalin Metanol Gliserol Aseton | Pengawet preparat biologi Antiseptik Bahan bakar Obat-obatan Pelumas |
Pasangan yang tepat antara senyawa dan kegunaannya adalah ....
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (5)
D. (3) dan (4)
E. (4) dan (5)
PEMBAHASAN
Senyawa-senyawa karbon mempunyai banyak manfaat. Berikut ini beberapa senyawa karbon dan manfaatnya.- Asam asetat atau asam cuka digunakan sebagai pemberi rasa asam pada makanan, bahan baku pembuatan polimer serat rayon, plastik, lem, cat, dan parfum.
- Formalin atau formaldehida (metanal) digunakan untuk menyimpan preparat biologi.
- Metanol merupakan bahan dasar pembuatan spiritus yang digunakan sebagai bahan bakar.
- Gliserol banyak digunakan dalam dunia kosmetika, biasanya digunakan untuk cream kulit. Gliserol juga digunakan sebagai obat-obatan, pelumas, dan bahan tinta.
- Aseton atau propanon digunakan sebagai bahan dasar plastik, serat, dan obat-obatan.
SOAL NO. 24 TENTANG IDENTIFIKASI SENYAWA KARBON
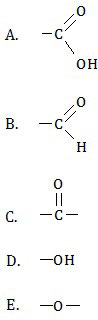
Hasil reaksi identifikasi zat organik dengan rumus molekul C2H4O.
(1) Zat tersebut dapat mereduksi pereaksi Fehling.Gugus fungsi senyawa tersebut adalah ....
(2) Dengan KMnO4 menghasilkan gas yang dapat memerahkan lakmus biru.
PEMBAHASAN
Rumus molekul C2H4O atau CnH2nO adalah rumus molekul untuk golongan aldehid atau keton. Dari opsi jawaban kita ketahui:A. asam karboksilat,Tinggal dua opsi yang betul, yaitu B dan C. Mari kita perhatikan perbedaan antara aldehid dan keton.
B. aldehid,
C. keton,
D. alkohol, dan
E. eter.
- Aldehid dapat bereaksi dengan larutan Fehling menghasilkan endapan merah bata sedangkan keton tidak.
- Oksidasi aldehid (bereaksi dengan KMnO4) menghasilkan asam karboksilat sedangkan keton tidak dapat dioksidasi.
- Reduksi aldehid menghasilkan alkohol primer sedangkan reduksi keton menghasilkan alkohol sekunder.
SOAL NO. 25 TENTANG MAKROMOLEKUL
Beberapa kegunaan makromolekul dalam tubuh di antaranya sebagai berikut.
(1) Menjaga keseimbangan asam basa.Kegunaan dari protein adalah pernyataan nomor ....
(2) Sumber energi bagi tubuh.
(3) Komponen pembuat jaringan baru atau memperbaiki jaringan yang rusak.
(4) Mempertahankan suhu badan dari pengaruh suhu rendah.
(5) Komponen penting dalam kontrol genetika.
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (4)
D. (3) dan (4)
E. (3) dan (5)
PEMBAHASAN
Kegunaan protein bagi tubuh antara lain:- membangun jaringan tubuh baru serta mengganti jaringan yang rusak,
- sebagai katalis, pengangkut, dan pelindung,
- mengatur metabolisme tubuh,
- menjaga keseimbangan antara asam dan basa serta keseimbangan cairan dalam tubuh, serta
- berperan sebagai enzim untuk mempercepat reaksi biologis.
SOAL NO. 26 TENTANG POLIMER
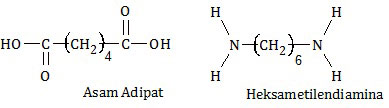
Dua jenis monomer, yaitu asam adipat dan heksametilendiamina.
Reaksi dua jenis monomer tersebut akan dihasilkan ....
PEMBAHASAN
Polimerisasi antara asam adipat (asam heksanadioat) dengan heksametilendiamina (diaminoheksana) termasuk polimerisasi kondensasi. Ciri polimerisasi kondensasi adalah:- monomernya tidak sejenis,
- monomernya mempunyai gugus fungsional pada kedua ujung rantainya, dan
- dihasilkan senyawa selain polimer dengan struktur yang lebih sederhana.
Reaksi polimerisasi tersebut adalah polimerisasi nilon 66. Pada polimerisasi tersebut, gugus -OH pada kedua ujung rantai asam adipat akan lepas. Demikian juga salah satu atom H pada kedua ujung rantai heksametilendiamina. Induk asam adipat dan induk heksametilendiamina membentuk nilon 66. Sedangkan gugus -OH dan atom H membentuk air.
Jadi, reaksi dua jenis monomer tersebut akan dihasilkan nilon 66 (A).
SOAL NO. 27 TENTANG ENERGETIKA
Perhatikan beberapa persamaan reaksi kimia dalam kehidupan sehari-hari berikut!
(1) C6H12O6 (aq) → 2 C2H5OH (aq) + 2 CO2 (g)Reaksi eksoterm terjadi pada ....
(2) C6H12O6 (aq) + O2 (g) → 6 CO2 (g) + 6 H2O (l)
(3) H2O (aq) → H2 (g) + ½ O2 (g)
(4) C8H18 (g) + 12½ O2 (g) → 8 CO2 (g) + 9 H2O (g)
(5) C (s) + 2 H2O (g) → CO2 (g) + 2 H2 (g)
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)
PEMBAHASAN
Reaksi eksoterm adalah reaksi yang melepaskan, membebaskan, mengeluarkan, atau menghasilkan kalor. Dengan demikian, pada akhir reaksi eksoterm terdapat kenaikan suhu, suhu menjadi lebih panas daripada sebelum reaksi. Yang termasuk reaksi eksoterm adalah:- reaksi pembakaran (reaksi dengan O2),
- reaksi netralisasi asam dan basa,
- reaksi korosi (oksidasi logam),
- reaksi polimerisasi,
- respirasi, dan
- dekomposisi tumbuhan menjadi kompos.
SOAL NO. 28 TENTANG ENERGETIKA
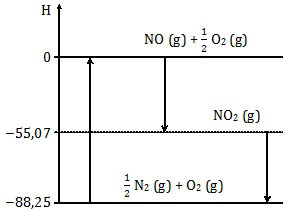
Perhatikan diagram entalpi berikut!
Entalpi reaksi ½ N2 (g) + O2 (g) → NO (g) + ½ O2 (g) adalah ....
A. -88,25 kJ
B. -55,07 kJ
C. -33,18 kJ
D. +33,18 kJ
E. +88,25 kJ
PEMBAHASAN
Dalam diagram entalpi, arah panah ke atas adalah reaksi endoterm sedangkan arah panah ke bawah berarti eksoterm. Reaksi ½ N2 (g) + O2 (g) → NO (g) + ½ O2 (g) adalah reaksi ke atas atau endoterm. Reaksi endoterm mempunyai harga ΔH positif. Opsi A, B, dan C sudah pasti salah.ΔHreaksi = ΔHhasil - ΔHpereaksiJadi, entalpi reaksi tersebut adalah +88,25 kJ (E).
ΔHreaksi = 0 - (-88,25) = +88,25
SOAL NO. 29 TENTANG KECEPATAN REAKSI
Berikut tabel hasil percobaan reaksi antara logam Q dengan larutan HCl 2M.
Laju reaksi pembentukan gas H2 pada suhu tersebut adalah ....
| No. | Suhu (°C) | Volume H2 (ml) | Waktu (detik) |
| 1 2 3 | 25 25 25 | 0 14 28 | 0 10 20 |
Laju reaksi pembentukan gas H2 pada suhu tersebut adalah ....
A. 0,7 ml/det
B. 1,0 ml/det
C. 1,4 ml/det
D. 2,0 ml/det
E. 2,8 ml/det
PEMBAHASAN
Karena tidak disebutkan valensi logam Q, ada dua kemungkinan reaksi antara logam Q dan larutan HCl.2 Q + 2 HCl → 2 QCl + H2Tapi, dari dua kemungkinan reaksi tersebut, perbandingan antara koefisien HCl dan H2 sama, yaitu 2 : 1. Secara kebetulan molaritas HCl 2 M, sebagaimana disebutkan pada soal.
Q + 2 HCl → QCl2+ H2
Dengan demikian, untuk mendapatkan laju reaksi pembentukan H2, langsung bisa digunakan rumus kelajuan umum. Data bisa diambil dari baris kedua atau ketiga pada tabel.
Adapun suhu, sebagaimana disebutkan dalam tabel, hanya berfungsi sebagai pemanis data. Suhu tidak berpengaruh karena semua menunjukkan angka 25 °C.
Jadi, laju reaksi pembentukan gas H2 adalah 1,4 ml/det (C).
SOAL NO. 30 TENTANG KESETIMBANGAN KIMIA
Pada reaksi kesetimbangan:
2 SO2 (g) + O2 (g) ↔ 2 SO3 (g) ΔH = −y kJJika volume diperkecil, kesetimbangan akan bergeser ke ....
A. kiri karena ke arah endoterm
B. kanan karena ke arah endoterm
C. kiri karena jumlah koefisien pereaksi lebih besar
D. kanan karena ke arah eksoterm
E. kanan karena jumlah koefisien hasil reaksi lebih kecil
PEMBAHASAN
Faktor yang memengaruhi pergeseran kesetimbangan:- Konsentrasi: jika konsentrasi ruas kiri diperbesar maka reaksi akan bergeser ke kanan. Sebaliknya, jika konsentrasi ruas kiri dikurangi maka reaksi akan bergeser ke kiri.
- Volume: jika volume sistem diperbesar maka reaksi akan bergeser ke ruas yang mempunyai jumlah koefisien lebih besar, demikian juga sebaliknya.
- Tekanan: jika tekanan sistem diperbesar maka reaksi akan bergeser ke ruas yang mempunyai jumlah koefisien lebih kecil, demikian juga sebaliknya.
- Suhu: Jika suhu sistem diperbesar maka reaksi akan bergeser ke endoterm, demikian juga sebaliknya.
SOAL NO. 31 TENTANG KECEPATAN REAKSI
Perhatikan gambar reaksi CaCO3 dengan larutan 10 ml HCl berikut!

Laju reaksi yang hanya dipengaruhi oleh suhu adalah ....

Laju reaksi yang hanya dipengaruhi oleh suhu adalah ....
A. (1) terhadap (2)
B. (1) terhadap (3)
C. (1) terhadap (5)
D. (2) terhadap (4)
E. (4) terhadap (5)
PEMBAHASAN
Reaksi akan berlangsung lebih cepat apabila tumbukan antarpartikel lebih sering terjadi. Faktor memengaruhi kecepatan reaksi:- Konsentrasi: semakin besar konsentrasi semakin cepat reaksi berlangsung (membuat minuman dari sirup pekat lebih cepat manis daripada sirup encer).
- Luas Permukaan: semakin besar luas permukaan semakin cepat reaksi berlangsung (membuat minuman dengan gula bubuk lebih cepat manis dari pada gula pasir).
- Suhu: semakin tinggi suhu semakin cepat reaksi berlangsung (membuat teh panas lebih cepat manis daripada membuat es teh).
- Katalis: katalis adalah pemercepat reaksi.
Jadi, laju reaksi yang hanya dipengaruhi oleh suhu adalah gambar 1 dan 3 (B).
SOAL NO. 32 TENTANG KESETIMBANGAN KIMIA
Dalam ruangan 2 liter terjadi reaksi kesetimbangan:
Harga tetapan kesetimbangan (Kc) dari data tersebut adalah ....
2 SO3 (g) ↔ 2 SO2 (g) + O2 (g)
| Keadaan Zat | SO3 (mol) | SO2 (mol) | O2 (mol) |
| Setimbang | 0,2 | 0,2 | 0,1 |
Harga tetapan kesetimbangan (Kc) dari data tersebut adalah ....
A. 10-2
B. 2 × 10-2
C. 5 × 10-2
D. 5 × 10-1
E. 2
PEMBAHASAN
Harga tetapan kesetimbangan konsentrasi (Kc) adalah perbandingan antara konsentrasi produk pangkat koefisien terhadap konsentrasi reaktan pangkat koefisien.Tabel di atas sangat membantu karena sudah menunjukkan data mol dalam keadaan setimbang. Kita tinggal memanfaatkan data pada tabel untuk dimasukkan langsung pada rumus tetapan kesetimbangan. Tapi perlu diingat, konsentrasi yang terdapat pada rumus tersebut adalah konsentrasi dalam satuan molar yang ditandai kurung siku. Sedangkan konsentrasi yang terdapat pada tabel masih dalam satuan mol. Jadi, masing-masing harus dibagi volume 2 liter terlebih dahulu.
[SO3] = 0,2 : 2 = 0,1Perlu dicatat, besarnya volume tidak akan memengaruhi perhitungan jika jumlah koefisien ruas kiri sama dengan jumlah koefisien ruas kanan. Hal ini karena perubahan volume pada kondisi tersebut tidak akan memengaruhi pergeseran kesetimbangan.
[SO2] = 0,2 : 2 = 0,1
[O2] = 0,1 : 2 = 0,05
Jadi, harga tetapan kesetimbangan (Kc) dari data tersebut adalah 5 × 10-2 (C).
SOAL NO. 33 TENTANG REAKSI REDUKSI DAN OKSIDASI
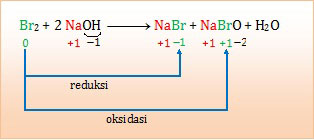
Pada reaksi berikut:
Br2 + 2 NaOH → NaBr + NaBrO + H2OZat yang mengalami reaksi disproporsionasi (autoredoks) berikut perubahan bilangan oksidasinya adalah ....
A. bromin dari -1 menjadi -2 dan 0
B. bromin dari 0 menjadi -1 dan +1
C. bromin dari 0 menjadi -2 dan+ 1
D. natrium dari +1 menjadi -1 dan 0
E. oksigen dari -2 menjadi -3 dan -1
PEMBAHASAN
Autoredoks atau disproporsionasi adalah reaksi redoks yang terjadi jika suatu unsur mengalami reduksi sekaligus oksidasi. Jadi unsur tersebut bertindak sebagai oksidator dan reduktor.Mari kita tentukan terlebih dahulu bilangan oksidasi masing-masing unsur selain H dan O. Dalam hal ini, untuk menentukan bilangan oksidasi, nilai koefisien tidak perlu dihitung.
Jadi zat yang mengalami reaksi autoredoks atau disproporsionasi adalah bromin dari 0 menjadi -1 dan +1 (B).
SOAL NO. 34 TENTANG ELEKTROKIMIA
Perhatikan reaksi setengah sel berikut!
Mg2+ + 2e → Mg Eo = -2,37 voltNotasi sel yang menunjukkan reaksi spontan adalah ....
Pb2+ + 2e → Pb Eo = -0,13 volt
Cu2+ + 2e → Cu Eo = +0,34 volt
Mn2+ + 2e → Mn Eo = -1,18 volt
A. Cu | Cu2+ || Mg2+ | Mg
B. Mn | Mn2+ || Mg2+ | Mg
C. Mg | Mg2+ || Pb2+ | Pb
D. Pb | Pb2+ || Mn2+ | Mn
E. Cu | Cu2+ || Pb | Pb2+
PEMBAHASAN
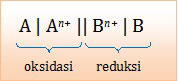
Notasi sel pada reaksi spontan.Untuk menerapkan notasi sel tersebut, mari kita urutkan unsur-unsur tersebut dari potensial reduksi terendah sampai tertinggi.
Harga Eo yang lebih kecil akan mengalami oksidasi sebaliknya harga Eo yang lebih besar akan mengalami reduksi. Dengan kata lain:
- Unsur yang letaknya lebih kiri akan mengalami oksidasi, sebaliknya unsur yang letak lebih kanan akan mengalami reduksi.
- Unsur yang letaknya lebih kiri akan berada di sebelah kiri dalam notasi sel, sebaliknya unsur yang letaknya lebih kanan akan berada di sebelah kanan dalam notasi sel.
- Kiri di kiri, kanan di kanan
A. Cu | Cu2+ || Mg2+ | Mg (salah, seharusnya Mg sebelah kiri)
B. Mn | Mn2+ || Mg2+ | Mg (salah, seharusnya Mg sebelah kiri)
C. Mg | Mg2+ || Pb2+ | Pb (betul, karena Eo Mg lebih kecil)
D. Pb | Pb2+ || Mn2+ | Mn (salah, seharusnya Mn sebelah kiri)
E. Cu | Cu2+ || Pb | Pb2+ (salah, seharusnya Pb sebelah kiri)
Jadi, notasi sel yang menunjukkan reaksi spontan adalah opsi (C).
SOAL NO. 35 TENTANG ELEKTROLISIS
Fluorin dapat diperoleh dari elektrolisis leburan KHF2 sesuai persamaan reaksi:
HF2- → HF + ½ F2 + eUntuk menghasilkan gas fluorin sebanyak 2,24 liter (STP), muatan listrik yang diperlukan adalah ... (1 F = 96.500)
A. 96.500 C
B. 19.300 C
C. 1.930 C
D. 965 C
E. 482,5 C
PEMBAHASAN
Soal di atas dapat diselesaikan dengan Hukum Faraday I yang dirumuskan:Karena yang ditanyakan adalah muatan, kita harus memasukkan besaran muatan (Q= i . t) dalam rumus tersebut. Selain itu, data tentang Ar dan massa (W) dari fluorin tidak disebutkan dalam soal tetapi ada data tentang volume dalam STP. Berarti kita bisa mendapatkan nilai mol dari fluorin. Itu artinya, Ar dan W bisa kita ganti dengan mol (mol = W/Ar). Dengan demikian diperoleh:
Q = mol . n . 96500Nilai mol fluorin dapat ditentukan dengan rumus:
Sedangkan n adalah valensi atau banyaknya mol elektron tiap mol zat. Bingung kan? Artinya begini, n adalah koefisien elektron (e) jika koefisien F sama dengan 1. Berarti persamaan di atas harus dijadikan:
2 HF2- → 2 HF + 1 F2 + 2 e (diperoleh n = 2)Sekarang nilai mol dan n sudah kita dapatkan. Tinggal kita masukkan ke dalam rumus:
Q = mol . n . 96500Jadi, muatan listrik yang diperoleh adalah 19.300 coulomb (B).
Q = 0,1 × 2 × 96500 = 19.300
SOAL NO. 36 TENTANG KOROSI
Cara yang tepat dilakukan untuk melindungi hiasan rumah yang terbuat dari besi dari peristiwa-peristiwa korosi adalah ....
A. dilapisi dengan perak
B. dilapisi dengan aluminium
C. proteksi katodik
D. dilumuri dengan oli
E. dilapisi dengan seng
PEMBAHASAN
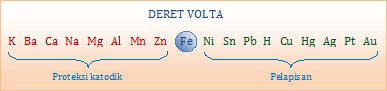
Cara mencegah korosi pada besi ada dua, yaitu proses pelapisan dan proteksi katodik. Perhatikan gambar Deret Volta berikut ini!Proses Pelapisan
Besi dicat atau dilapisi dengan logam lain yang sukar teroksidasi (sebelah kanan besi pada deret volta). Contoh, besi dilapisi perak, platina, timah, atau nikel.Proteksi Katodik
Besi dihubungkan dengan logam lain yang mudah mengalami oksidasi (sebelah kiri besi pada deret volta). Logam yang paling baik sebagai proteksi katodik adalah Mg. Bila Mg dihubungkan dengan besi maka Mg akan terserang karat sampai habis sehingga besi selamat dari korosi. Proteksi katodik biasanya untuk skala besar, misal melindungi pipa pabrik dari korosi.Jadi, cara yang tepat dilakukan untuk melindungi hiasan rumah yang terbuat dari besi dari peristiwa korosi adalah dengan melapisi perak (A).
SOAL NO. 37 TENTANG UNSUR TRANSISI PERIODE KEEMPAT
Sifat-sifat suatu senyawa sebagai berikut:
Contoh senyawa yang mempunyai sifat tersebut adalah ....
| No. | Sifat-sifat Senyawa |
| 1 2 3 4 | Senyawanya berwarna Paramagnetik Membentuk senyawa kompleks Mengalami reaksi oksidasi |
Contoh senyawa yang mempunyai sifat tersebut adalah ....
A. NaCl
B. FeSO4
C. CaCO3
D. Mg(NO3)2
E. SrSO4
PEMBAHASAN
Sifat-sifat senyawa yang disebutkan pada tabel adalah sifat-sifat yang dimiliki oleh senyawa yang berasal dari unsur transisi periode keempat. Unsur-unsur transisi periode keempat:Sc Ti V Cr Mn Fe Co Ni Cu ZnJadi, senyawa yang mempunyai sifat sebagaimana tersebut pada tabel adalah FeSO4(B). Adapun senyawa yang lain, berasal dari unsur-unsur logam golongan utama.
SOAL NO. 38 TENTANG UNSUR RADIOAKTIF
Perhatikan sifat unsur berikut!
(1) Dapat menghitamkan plat foto.Sifat unsur radioaktif terdapat pada nomor ....
(2) Memancarkan cahaya tampak.
(3) Memancarkan sinar ultraungu.
(4) Memancar radiasi dengan daya tembus kuat.
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (4)
E. (3) dan (4)
PEMBAHASAN
Sifat-sifat unsur radioaktif:- memengaruhi/menghitamkan plat film,
- mengionkan gas yang disinari,
- daya tembus tinggi (menembus kertas atau lempengan logam tipis),
- menyebabkan benda yang berlapis ZnS berpendar (berfluoresensi), dan
- dapat diuraikan oleh medan magnet menjadi sinar α, β, dan γ.
SOAL NO. 39 TENTANG PEMBUATAN UNSUR DAN SENYAWANYA
Suatu logam dapat diperoleh dengan memurnikan mineralnya dan elektrolisis dengan persamaan reaksi:
2 Al2O3 (s) → 4 Al (s) + 3 O2 (g)Proses pembuatan unsur tersebut dikenal dengan nama ....
A. Wohler
B. Kontak
C. Frasch
D. tanur tiup
E. Hall-Heroult
PEMBAHASAN
Proses pembuatan unsur logam dan senyawa:Sel Dawn
Sel Dawn adalah proses pembuatan unsur-unsur logam golongan alkali dan alkali tanah. Proses pembuatannya melalui reaksi elektrolisis lelehan garam kloridanya. Misal pembuatan logam natrium.
NaCl → Na+ + Cl-Hall-Heroult
katoda: Na+ + e → Na
anoda: 2 Cl- → Cl2 + 2 e
Hall-Heroult adalah proses pembuatan logam aluminium dari bauksit. Pengolahan aluminium dari bauksit berlangsung dalam dua tahap. Tahap pertama adalah pemurnian bauksit menjadi Al2O3 murni (alumina). Tahap kedua adalah reduksi alumina melalui elektrolisis. Reaksi akhirnya adalah:
2 Al2O3 (s) → 4 Al (s) + 3 O2 (g)Tanur Tinggi atau Tanur Tiup
Tanur tinggi atau tanur tiup adalah sebuah tungku yang digunakan untuk mengolah besi dari bijihnya (Fe2O3). Besi yang dihasilkan dari tanur tiup disebut besi gubal (pig iron) atau besi kasar. Reaksi totalnya adalah:
Fe2O3 (s) + 3 CO (g) → 2 Fe (l) + 3 CO2 (g)Selanjutnya, silakan dihafal tabel berikut ini.
| Nama Proses | Unsur atau Senyawa yang Dihasilkan |
| Sel Dawn Hall-Heroult Tanur Tiup Goldschmidt Kalsinasi Deacon, Weldon Frasch Haber-Bosch Wohler Kontak Oswald | Natrium dan Magnesium Aluminium Besi Krom Logam Alkali Klorin Belerang Amonia Urea dan fosfor Asam sulfat Asam nitrat |
Jadi, proses pembuatan aluminium dikenal dengan nama Hall-Heroult E).
SOAL NO. 40 TENTANG UNSUR ALKALI DAN ALKALI TANAH
Berikut senyawa yang mengandung unsur golongan IA dan IIA.
(1) KNO3Senyawa yang digunakan untuk membuat campuran garam dapur dan mematangkan buah adalah ....
(2) NaIO3
(3) CaC2
(4) SrSO4
(5) Na2SO4
(6) K2SO4
A. (1) dan (2)
B. (2) dan (3)
C. (3) dan (4)
D. (4) dan (5)
E. (5) dan (6)
PEMBAHASAN
Mari kita telusuri satu per satu senyawa yang mengandung unsur golongan IA dan IIA sebagaimana yang disebutkan pada soal.- KNO3 (kalium nitrat atau potasium nitrat) adalah pupuk kimia dengan kandungan kalium (K) dan nitrogen (N) yang sangat penting untuk merangsang pertumbuhan dan mencegah kerontokan bunga dan buah.
- NaIO3 adalah garam beryodium untuk mencegah penyakit gondok.
- CaC2 (kalsium karbida atau karbit) biasanya digunakan untuk mempercepat kematangan buah.
- SrSO4 (strontium sulfat) biasanya digunakan sebagai bahan cat.
- Na2SO4 (natrium sulfat) digunakan dalam pembuatan deterjen dan pulp kertas (proses kraft.
- K2SO4 (kalium sulfat) adalah pupuk kimia untuk tanaman.
sumber : http://kakajaz.blogspot.co.id/search/label/Pembahasan%20Kimia%20UN%202014

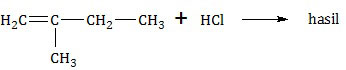
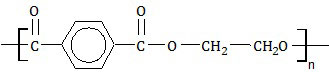
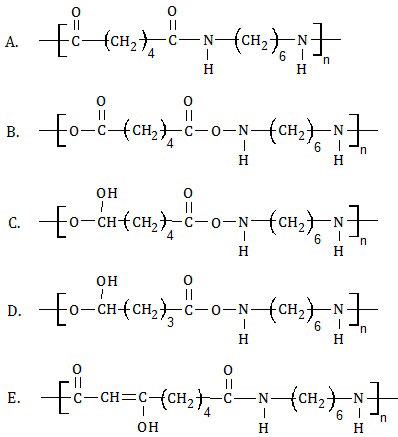


Terima kasih banyak atas ulasan pembahasannya. Sangat membantu :)
BalasHapusTerima kasih sangat membantu sekali, pembahasannya juga mantul
BalasHapusTerimakasihhh :) semoga dibales kebaikannya sama Allah :)
BalasHapusTerimakasih bang, 1 minggu lagi UN kimia
BalasHapusTerima kasih,ini sangat membantu����
BalasHapus